翻译后修饰组学
与常规蛋白质组不同,翻译后修饰蛋白质组学是探究蛋白质翻译后修饰对生命活动产生的影响,应用范围包括药物靶点的鉴定、临床标志物的筛选等。
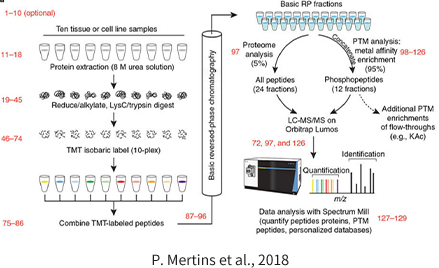
蛋白质磷酸化修饰(Phosphorylation)是生物体内最为重要、含量最丰富、研究最为深入的修饰方式,很多富集方法首先在磷酸化蛋白质组学分析中开发和利用。其中 , 富集方法有二氧化钛(TiO2)、IMAC-Fe和基序抗体富集法。
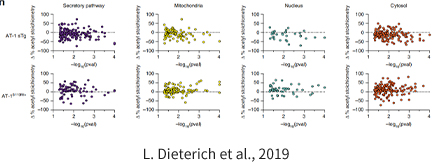
乙酰化是一种高度保守和可逆的翻译后修饰。它主要通过修饰核蛋白参与调控基因表达,也能调控多种代谢酶和代谢途径。在蛋白质组学研究中,已经发现了成干上万的乙酰化蛋白。然而,大多数乙酰化蛋白的丰度都很低。乙酰肽的富集有助于提高质 谱分析的灵敏度。我们使用 CST 乙酰化特异性抗体对乙酰肽进行富集,并使用 2-3 种不同的酶对蛋白进行消化,确保对乙酰肽进行全扫描。
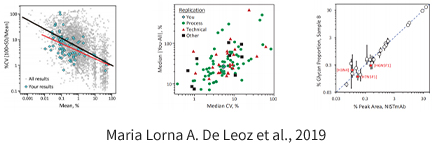
泛素化修饰是一种重要的翻译后修饰,泛素蛋白酶体系统介导了真核生物 80%~85% 的蛋白质降解。除参与蛋白质降解之外,泛素化修饰还参与了细胞周期、增殖、细胞凋亡、分化、转录调控、基因表达、转录调节、信号传递、损伤修复、炎症免疫等几乎一切 生命活动的调控。泛素化与肿瘤、心血管等疾病的发病密切相关。因此,作为近年来生物化学研究的一个重大成果,它已然成为研究、开发新药物的新靶点。

糖基化修饰影响着蛋白质的空间构象、生物活性、运输和定位,在分子识别、细胞通信、信号转导等特定生物过程中发挥着至关重要的作用。糖蛋白根据其糖链结构及糖基化位点主要有N-糖蛋白与 O-糖蛋白两大类。据推断,有超过50%的蛋白质都发生了糖基化修饰,但由于糖基化的高度复杂性,绝大多数糖蛋白尚未被发现,现有数据中只有约10%的蛋白质被注释为糖蛋白。仅仅由6个不同单糖组成的寡糖链,其结构就可能达到惊人的1012种。
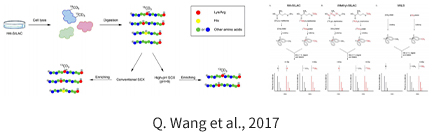
蛋白甲基化是一种常见的蛋白翻译后修饰,主要发生在精氨酸和赖氨酸残基上。精氨酸甲基化可调控 RNA 加工、基因转录、DNA 损伤修复、蛋白转位及信号转导等过程。精氨酸甲基化主要参与组蛋白功能、转录及表观遗传学调控。
Copyright © 2015-2023 苏州帕诺米克生物医药科技有限公司 版权所有