
MobiNova-100 单细胞转录组
MobiNova-100®单细胞测序建库系统是由墨卓生物自主研发的高质量、高稳定性、高性价比的国产单细胞测序平台,由中美四院院士David Weitz教授最新升级的液滴微流控单细胞技术转化技术而来。 MobiNova-100®采用分子标签(barcode)的单细胞识别,利用独家专利的标签和油包水技术,通过优化微流控芯片的设计和仪器控制,在液滴生成时稳定实现细胞分离和微球、试剂、细胞的共包裹达到较高的细胞捕获率。
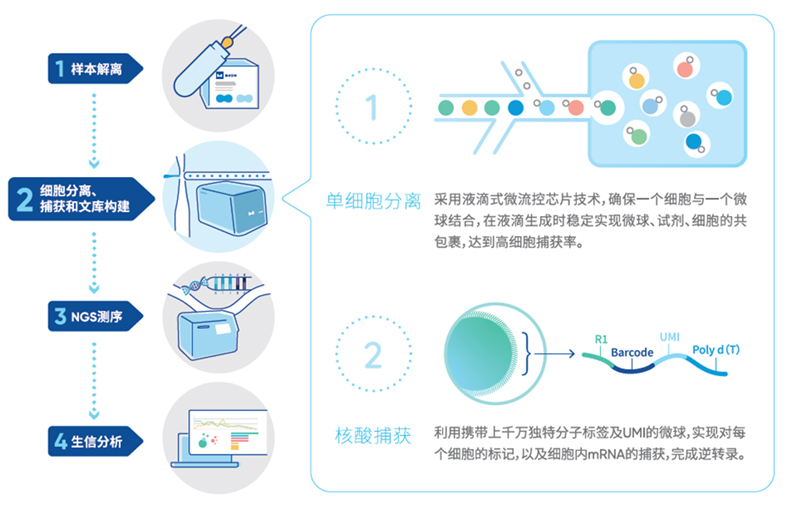
MobiNova-100引入了独有的LightCut光激发分离技术,使用紫外光照射的方式将完成核酸捕获的分子标签从微球上脱落下来。相比于10× Genomics的溶解微球的形式,可以避免溶解产生的高分子化合物进入后续反应体系,进而影响后续的逆转录反应。
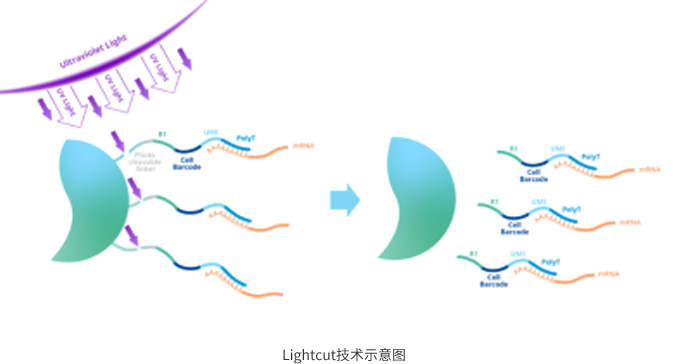
MobiNova-100的微流控芯片采用了高速流道设计,可进一步提高微球包裹速度,6min完成核酸捕获,一方面可以缩短核酸捕获的时间,减少mRNA分子的降解;另外一方面可使一个细胞匹配更多的微球分子,从而降低多胞率,减少测序数据的浪费。
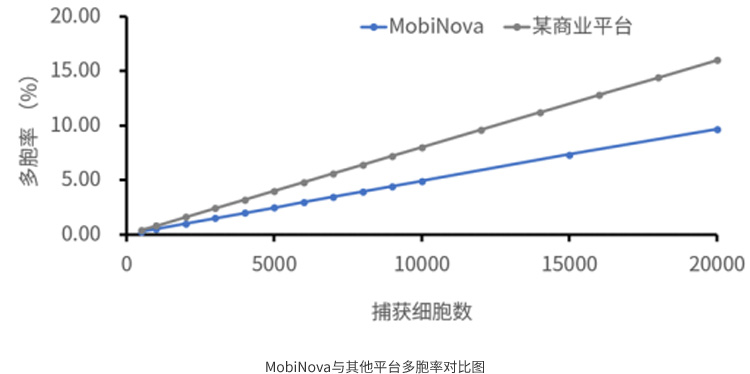
MobiNova-100在芯片的细节设置上,微流控芯片采用了细胞和试剂“分区”设计,添加了一个加样孔,可以避免在上机等待时间里面,试剂对细胞产生刺激,进而影响基因表达,即规避细胞应激反应风险,降低系统误差。
发表期刊:PNAS 影响因子:11.1 发表时间:2021.12
肿瘤组织的异质性是当前研究的热点之一。肿瘤内细胞与细胞间的异质性,为癌症的诊断,治疗以及相关药物的开发带来了极大的困难。 人体的多细胞系统,包括器官、肿瘤、和胚胎均由异质且相关的单细胞组成,但均发源于同质且均一的细胞类群。了解异质且有序的生物系统如何从同质且单一的细胞中发展而来是生命科学的根本问题之一。 现今的研究认为生物异质性的主要来源有:基因组的不稳定性,程序化细胞分化,基因突变的累积,或者是时空间有序的生长因子信号刺激。尽管各种生化因素和遗传因素的单细胞异质性来源被逐步揭示,但由微环境中物理力学因素导致的细胞异质性起源机制并不明确。
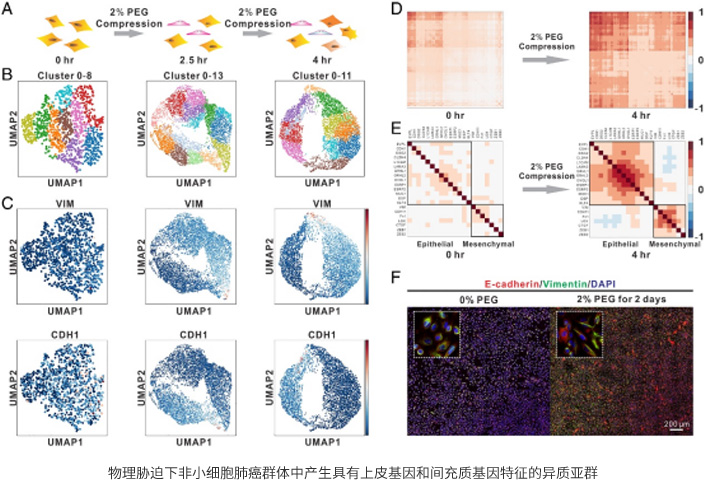
本研究发现单一种类的力学信号,可以在同一种均质的非小细胞肺癌细胞中诱导出两种截然不同的细胞表型, 并导致单细胞异质性的产生。进一步研究发现,力学诱导的新型细胞亚型具有皮质间充质转化相关的特征基因和肿瘤干细胞相关的特征基因。对皮质间充质转化的基因调控网络进行数学建模发现,初始的同质非小细胞肺癌细胞处于该调控网络中的中间态,即皮质/间充质杂合态。 力学诱导所产生的细胞分别位于中间态两侧的“皮质”和“间充质”两种稳态。力学挤压增强了单细胞间基因表达的噪音(变异系数),这就导致细胞的转录谱偏离细胞原来所处的中间稳态,使细胞随机向调控网络中另外两个稳态进行转变,最终形成了细胞命运的双向转化这一现象。
Zhao X, Hu J, Li Y, et al. Volumetric compression develops noise-driven single-cell heterogeneity[J]. PNAS, 2021, 118(51): e2110550118.
Copyright © 2015-2023 苏州帕诺米克生物医药科技有限公司 版权所有